
เนื้อหา
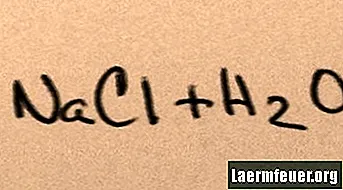
เมื่อเติมเกลือลงในน้ำจะสลายไปในโมเลกุลของส่วนประกอบจนกระทั่งไอออนของเกลือสูงสุดที่น้ำสามารถรองรับได้ลอยอยู่รอบ ๆ โมเลกุลของไฮโดรเจนและออกซิเจน เมื่อสิ่งนี้เกิดขึ้นสารละลายจะเรียกว่า "อิ่มตัว" เมื่อเกลือละลายมากขึ้นโซเดียมและคลอไรด์ไอออนจะชนกันและรวมตัวกันใหม่ในผลึกเกลือ ปรากฏการณ์นี้เรียกว่า "การตกตะกอน" เนื่องจากของแข็งที่ก่อตัวตกลงไปที่ก้นน้ำ เกลือเป็นสาร "ชอบน้ำ" นั่นคือพวกมันจะดึงดูดน้ำ สถานที่ท่องเที่ยวแห่งนี้เอื้อต่อการตกตะกอนในรูปแบบที่คุ้นเคย: เม็ดฝนก่อตัวรอบผลึกเกลือเล็ก ๆ ในเมฆทำให้มีรสเค็มเล็กน้อย
พื้นฐาน

อิเล็กโทรไลต์

เกลือไม่นำไฟฟ้าในสถานะของแข็ง แต่ในสถานะของเหลว (ของเหลว) จะสร้างสารละลายที่สามารถนำไฟฟ้าได้ดีมาก การนำไฟฟ้าขึ้นอยู่กับชนิดของเกลือที่ใช้ แต่ของเหลวเหล่านี้เรียกว่าสารละลายอิเล็กโทรไลต์เป็นพาหะที่ดีเยี่ยมของสารประกอบที่ร่างกายมนุษย์ต้องการ แรงกระตุ้นไฟฟ้าที่สมองสร้างขึ้นจะผลิตออกซิเจนอิสระซึ่งเลือดจะถูกใช้ไป โมเลกุลของเกลือแบ่งออกเป็นอิเล็กโทรไลต์ (โซเดียมโพแทสเซียมหรือแคลเซียม) และคลอไรด์ในสารละลาย: คลอไรด์จะถูกสูบฉีดโดยเลือดและไตเข้าไปในปัสสาวะและอิเล็กโทรไลต์จะถูกกระจายผ่านระบบประสาทและกล้ามเนื้อในกระบวนการที่นักกีฬาเรียกว่า การคืนน้ำ
คุณสมบัติ colligative

สารละลายใด ๆ ที่แตกต่างไปจากองค์ประกอบดั้งเดิมเนื่องจากการเพิ่มโมเลกุลแม้ว่าจะไม่ได้สร้างสารประกอบใหม่น้ำหนักโมเลกุลของของเหลวจะเปลี่ยนแปลงและส่งผลต่อคุณสมบัติของมัน น้ำเกลือมีความหนาแน่นมากกว่าน้ำบริสุทธิ์และยังแข็งตัวช้ากว่าด้วย อย่างไรก็ตามในขณะที่มันแข็งตัวเกลือจะเคลื่อนตัวไปที่ขีด จำกัด ของของเหลวทำให้หนักขึ้นและอิ่มตัวมากขึ้นจากนั้นจึงลดจุดเยือกแข็งลง ในอีกด้านหนึ่งของสถานะของสสารยิ่งน้ำเกลือมีความหนาแน่นมากเท่าไหร่ก็ยิ่งต้องใช้ความร้อนมากขึ้นในการระเหยจนกว่าน้ำจะหมดจนเหลือชั้นของเกลือ ปรุงอาหารรอให้น้ำในหม้อเดือดเติมเกลือลงไปเพื่อไม่ให้เครื่องร้อนช้า คุณสมบัติเหล่านี้หรือที่เรียกว่า "colligative properties" ช่วยให้นักวิทยาศาสตร์ระบุน้ำหนักโมเลกุลของน้ำเกลือได้ หากสามารถวัดมวลความดันบรรยากาศและจุดเดือดของของเหลวได้นักวิทยาศาสตร์สามารถลบน้ำหนักโมเลกุลของน้ำเพื่อหาว่ามีเกลืออยู่