
เนื้อหา
อิเล็กตรอน Valence เป็นอิเล็กตรอนของชั้นนอกสุดที่อะตอมสามารถเติมได้ มีความสำคัญเนื่องจากมักเกี่ยวข้องกับปฏิกิริยาเคมี ตารางธาตุเป็นข้อมูลอ้างอิงเชิงปฏิบัติสำหรับการพิจารณาจำนวนของวาเลนซ์อิเล็กตรอนในอะตอมอย่างรวดเร็ว อย่างไรก็ตามมันควรจะสังเกตว่าองค์ประกอบหลายอย่างส่วนใหญ่เป็นโลหะทรานซิชันและแม้แต่บางอโลหะอาจมีหลายรัฐวาเลนซ์ขึ้นอยู่กับสารประกอบเฉพาะ
คำสั่ง
-
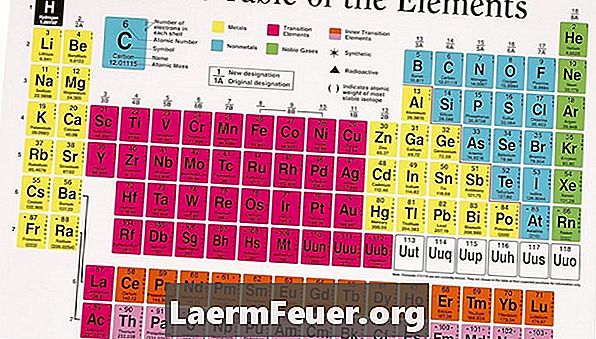
ค้นหาองค์ประกอบในตารางธาตุ พวกเขาจะอยู่ในตารางตามหมายเลขอะตอมจากซ้ายไปขวาบนลงล่าง การจัดเรียงขององค์ประกอบในสายสอดคล้องกับคุณสมบัติที่ใช้ร่วมกันระหว่างพวกเขาในคอลัมน์ที่กำหนดอย่างมีนัยสำคัญควบคุมโดยความคล้ายคลึงกันในการจัดเรียงของอิเล็กตรอนเหล่านี้
-
ระบุคอลัมน์ที่มีองค์ประกอบอยู่ แต่ละคอลัมน์มีชื่อโดยมีตัวเลขใกล้กับด้านบน ปัจจุบันระบบการกำหนดหมายเลขที่ IUPAC ยอมรับนั้นมีหมายเลขเรียงตามลำดับจาก 1 ถึง 8 ก่อนหน้านี้ IUPAC ชื่อคอลัมน์ 1A, 2A, 3A และอื่น ๆ ในขณะที่ตารางธาตุใหม่ต้องถูกดัดแปลงให้เข้ากับระบบใหม่ แต่ตารางเก่าสามารถใช้ระบบการตั้งชื่อก่อนหน้านี้ได้
-
นับจำนวนคอลัมน์จากซ้ายไปขวาละเว้นโลหะทรานซิชันและคอลัมน์สุดท้ายทางขวา เขียนเป็นจำนวนอิเล็กตรอนของวาเลนซ์ ตัวอย่างเช่นการใช้ระบบหมายเลขก่อนหน้านี้เพียงแค่เขียนเลขโรมันในคอลัมน์ชื่อเป็นหมายเลขอิเล็กตรอนวาเลนซ์สำหรับองค์ประกอบในกลุ่ม IA, IIA, IIIA, IVA, VA, VIA และ VIIA
-
เขียนเลขศูนย์สำหรับจำนวนของอิเล็กตรอนวาเลนซ์สำหรับองค์ประกอบของกลุ่ม 18 (เดิมชื่อกลุ่ม VIIIA) องค์ประกอบเหล่านี้นำเสนอชั้นอิเล็กตรอนชั้นนอกสุดและโดยทั่วไปจะไม่เกี่ยวข้องกับปฏิกิริยาเคมี
-
เขียนคำว่า "เปลี่ยนแปลง" สำหรับองค์ประกอบที่อยู่ในบล็อกโลหะทรานซิชันของตารางธาตุเนื่องจากการจัดเรียงของอิเล็กตรอนในองค์ประกอบเหล่านี้ช่วยให้ผู้ที่อยู่ในชั้นในสุดจะมีส่วนร่วมในปฏิกิริยาทางเคมี สิ่งนี้ทำให้พวกเขาดูเหมือนจะมีความจุที่เปลี่ยนแปลงในปฏิกิริยาที่แตกต่างกัน ยกตัวอย่างเช่นเหล็กบางครั้งตอบสนองโดยใช้อิเล็กตรอนสองตัวและอีกสามตัวให้ความจุที่ชัดเจนของสองหรือสาม
สิ่งที่คุณต้องการ
- ตารางธาตุ