
เนื้อหา
- จำนวนอิเล็กตรอนในเปลือกวาเลนซ์
- ขั้นตอนที่ 1
- ขั้นตอนที่ 2
- ขั้นตอนที่ 3
- ขั้นตอนที่ 4
- โครงสร้าง Lewis
- ขั้นตอนที่ 1
- ขั้นตอนที่ 2
- ขั้นตอนที่ 3
- ประจุทางการของแต่ละอะตอม
- ขั้นตอนที่ 1
- ขั้นตอนที่ 2
- ขั้นตอนที่ 3
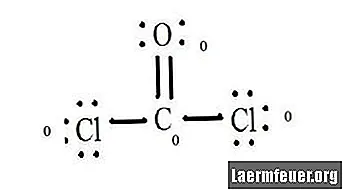
เมื่อพิจารณาประจุที่เป็นทางการของโมเลกุลเช่น CoCl2 (ก๊าซฟอสจีน) จำเป็นต้องทราบจำนวนอิเล็กตรอนในชั้นวาเลนซ์ของแต่ละอะตอมและโครงสร้างลิวอิสของโมเลกุล
จำนวนอิเล็กตรอนในเปลือกวาเลนซ์
ขั้นตอนที่ 1
มองหาแต่ละอะตอมในตารางธาตุเพื่อกำหนดจำนวนอิเล็กตรอนในวาเลนซ์เชลล์
ขั้นตอนที่ 2
โปรดจำไว้ว่าอิเล็กตรอนสองตัวอยู่ที่ระดับย่อยแรก s สองตัวอยู่ที่ระดับย่อยที่สอง s อิเล็กตรอนหกตัวที่ p ระดับย่อยแรกเป็นต้น ข้อควรจำ: 1s (^ 2) 2s (^ 2) 2p (^ 6) 3s (^ 2) 3p (^ 6)
ขั้นตอนที่ 3
กดโหลด ถ้าโมเลกุลเป็นไอออนให้บวกหรือลบอิเล็กตรอนหนึ่งตัวหรือมากกว่าจากทั้งหมดเพื่อให้ได้ประจุสุดท้าย
ขั้นตอนที่ 4
สำหรับ CoCl2 (ก๊าซฟอสจีน): C = 4; O = 6; Cl = 7 โมเลกุลไม่แตกตัวเป็นไอออนและมีประจุเป็นกลาง ดังนั้นจำนวนอิเล็กตรอนทั้งหมดในเวเลนซ์เชลล์คือ 4 + 6 + (7x2) = 24
โครงสร้าง Lewis
ขั้นตอนที่ 1
ดูแผนภาพโครงสร้างลิวอิสของ CoCl2 (ก๊าซฟอสจีน) โครงสร้างลิวอิสแสดงถึงโครงสร้างที่เสถียรและเป็นไปได้มากที่สุดสำหรับโมเลกุล อะตอมถูกดึงด้วยเวเลนซ์อิเล็กตรอนคู่ เกิดพันธะระหว่างอิเล็กตรอนอิสระเพื่อให้เป็นไปตามกฎออกเตต
ขั้นตอนที่ 2

วาดแต่ละอะตอมและเวเลนซ์อิเล็กตรอนจากนั้นสร้างพันธะตามต้องการ
ขั้นตอนที่ 3
อะตอมของคลอไรด์มีพันธะร่วมกับโมเลกุลของคาร์บอนในขณะที่อะตอมของออกซิเจนสร้างพันธะคู่กับคาร์บอน แต่ละอะตอมในโครงสร้างสุดท้ายเป็นไปตามกฎอ็อกเต็ตและมีอิเล็กตรอนแปดตัวในเปลือกวาเลนซ์ทำให้มีเสถียรภาพของโมเลกุล
ประจุทางการของแต่ละอะตอม
ขั้นตอนที่ 1
นับคู่ที่ไม่มีอิเล็กตรอนของแต่ละอะตอมในโครงสร้างลิวอิส แต่ละอะตอมจะถูกกำหนดอิเล็กตรอนจากแต่ละพันธะที่มีส่วนร่วม เพิ่มตัวเลขเหล่านั้น ใน CoCl2: C = 0 คู่อิสระบวก 4 อิเล็กตรอนของพันธะ = 4 อิเล็กตรอน O = อิเล็กตรอนคู่อิสระ 4 คู่บวกพันธะ 2 อิเล็กตรอน = 6 อิเล็กตรอน Cl = 6 อิเล็กตรอนของคู่อิสระบวกหนึ่งอิเล็กตรอนของพันธะที่มี C = 7 อิเล็กตรอน
ขั้นตอนที่ 2
ลบจำนวนอิเล็กตรอนในเวเลนซ์เชลล์ในอะตอมที่ไม่ถูกผูกไว้ ผลลัพธ์ที่ได้คือประจุทางการสำหรับแต่ละอะตอม ใน CoCl2: C = 4 เวเลนซ์อิเล็กตรอน (ev) ในอะตอมที่ไม่ถูกยึดลบด้วยอิเล็กตรอน 4 ตัวที่กำหนดไว้ในโครงสร้าง Lewis (LS) = 0 ประจุทางการ O = 6 ev - 6 LS = 0 ประจุทางการ Cl = 7 ev - 7 LS = 0 สินค้าทางการ
ขั้นตอนที่ 3
เมื่อเขียนให้วางประจุเหล่านี้ไว้ใกล้กับอะตอมในโครงสร้างลิวอิส ถ้าโมเลกุลมีประจุรวมให้วางโครงสร้างลิวอิสไว้ในวงเล็บโดยมีประจุเขียนไว้ด้านนอกที่มุมขวาบน